
Pradavnina
Leta 1936 so arheologi v bližini Bagdada našli glinen vrč, bakren tulec in železno palico. Verjamejo, da gre za prabaterijo, staro prek 2000 let. Ko so železno palico vstavili v tulec, tega v vrč in vanj nalili navaden kis (elektrolit, tekočina ki prevaja električni tok), se je med obema elektrodama (baker, železo) pojavil električni tok. Za kaj so stari Perzijci vrč uporabljali, ni jasno. Morda so z njim strašili vernike (elektrošok), saj ni podatkov, da bi razumeli osnove električne energije. Ali pa, kot trdijo nekateri, so to tehnologijo ljudem dali obiskovalci iz vesolja in so na primer Egipčani pri gradnji piramid to uporabljali kot električno svetilko v temnih rovih svojih grobnic. Kdo bi vedel!

1800
Luigi Galvani je seciral žabje krake, obešene na medeninast kavelj. Dotaknil se je noge s kovinskim nožem in noga je trznila. Galvani je napačno predvideval, da je odkril energijo, shranjeno v živalskem tkivu, in jo poimenoval živalska elektrika. Dobro, da je sočasno živel Alessandro Volta, ki je pravilno predvideval, da sta elektriko povzročili dve kovini (medenina, železo), ki sta bili »združeni« prek žabjega tkiva (to je delovalo kot elektrolit v današnjih baterijah). Malce se je igral v svojem laboratoriju in izumil prvo baterijo, pri kateri je uporabil cink in baker, kot elektrolit pa v slanici namočeno tkanino. Ker tok, ki ga je ta baterija zagotavljala, ni zadostoval za iskro, je raziskoval naprej in preizkušal različne kovine. Ugotovil je, da najboljše rezultate dobi s kombinacijo cinka in srebra. Je pa tudi Volta naredil veliko napako − razmišljal je, da do toka pride zaradi kontakta kovin, ne pa zaradi kemične reakcije.

Do leta 1835
Različni znanstveniki, vključno z Volto, so se igrali s prvo baterijo in izboljševali njene slabosti – najočitnejše je bilo iztekanje elektrolita in s tem kratkega stika. William Cruickshank je obrnil Voltovo baterijo, tako da elementi niso bili več zloženi eden na drugega. Nastala je prva prava baterija. Težave, povezane s prehitro degradacijo cinka zaradi nečistoč v njem, je rešil William Sturgeon, tako da je cinkovo elektrodo zamenjal z elektrodo iz zmesi cinka in živega srebra.
1836
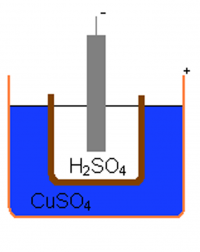
Ostala je težava, povezana s kratko življenjsko dobo prvih baterij – na bakreni elektrodi se je nabiral vodik in povzročal vse večji notranji električni upor baterije. John Frederic Daniell je težavo rešil tako, da je uporabil dva elektrolita. Drugi je vezal (porabil) vodik, ki ga je sproščal prvi. Njegova baterijo poznamo kot Daniellova celica – sestavlja jo bakren lonček, napolnjen s bakrenim sulfatom, v katerega je vstavljena porozna lončena posoda z žvepleno kislino in cinkovo elektrodo. Pore so omogočale prehod ionov, elektrolita pa se nista mešala, življenjska doba baterije je bila daljša, a kljub temu neprimerljiva z današnjimi baterijami.
1844
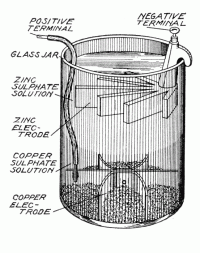
William Robert Grove še izboljša Daniellovo celico. Njegovo celica proizvaja višji tok in skoraj dvakrat večjo napetost. Tako imenovana gravitacijska celica (izumitelj Callaud) je naslednja izboljšava Daniellove celice iz leta 1860. Leta 1866 je Georges Leclanche izdelal celico, ki jo je poimenoval po sebi (ali ste sploh pričakovali kaj drugega?). Celica napetosti med 1,4 in 1,6 V je bila sposobna zagotoviti konstantni tok za takratne razmere zelo dolgo časa.
1859
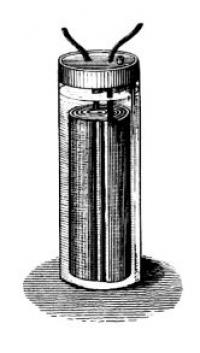
Do tega datuma baterij ni bilo moč ponovno napolniti. Ko so izrabile kovino, potrebno za kemično reakcijo, so jih zavrgli (kamorkoli, saj takrat še niso bilo okoljsko osveščeni). Gaston Plante izumi tisto, kar danes najdemo v vsakem vozilu – akumulator, v katerem sta svinec in kislina – prvo baterijo, ki jo lahko ponovno napolnimo. Njegovo baterijo sestavljata svinčena anoda in katoda iz svinčevega oksida, obe pa sta potopljeni v žvepleno kislino. Obe elektrodi reagirata s kislino in prek kemične reakcije tvorita svinčev sulfat. Če na to baterijo priključite električni tok, steče reakcija v obratni smeri. Tako se baterija polni.
Okoli leta 1887
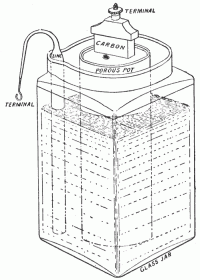
Pojavi se prva suha baterija, ki ne vsebuje elektrolita v tekočem stanju. Carl Gassner vzame za osnovo Leclanchevo baterijo. Amonijev klorid zmeša z snovjo, malto, ki je bila takrat znana kot »plaster of Paris«. Nastane pasta, ki deluje kot elektrolit. V to pasto je vtisnjena katoda iz magnezijevega dioksida, oboje pa je lončku iz cinka, ki deluje kot anoda. Ker elektrolit ne more izteči iz baterije, je ta varnejša za uporabo in ne zahteva posebnega vzdrževanja (napetost 1,5V). Ko so pariško malto zamenjali z zavitim kartonom, so dobili tako imenovano cink-ogljikovo baterijo, ki jih izdelujejo še danes.
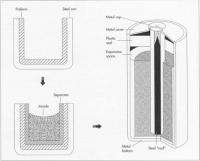
1899
Waldmar Junger izumi prvo alkalno baterijo. Natančneje, nikelj-kadmijevo baterijo, ki jo je moč ponovno napolniti. Kot elektrolit rabi raztopina kalijevega hidroksida. Izumi tudi nikelj-železovo baterijo, vendar opazi, da ta proizvaja preveč vodika in zato zadeve ne patentira. Naredi pa to Thomas Alva Edison, ki je želel to baterijo uporabiti namesto svinčenih akumulatorjev v prvih avtomobilih. Leta 1955 Lewis Urry dodatno izboljša alkalno baterijo, ki postane cenejša. Katoda je iz magnezijevega dioksida, cink pa je v obliki prahu, kar poveča aktivno površino anode.

1980
Stanford R. Ovshinsky izumi nikelj-metalno hibridno baterijo (NiMH), različico nikelj-kadmijeve baterije (NiCad), tako da kadmijevo elektrodo zamenja s katodo, izdelano iz plasti, ki absorbira vodik (običajno mešanica redkih kovin). Njegove baterije imajo daljšo življenjsko dobo.

1970 in 1990
Litij ima izmed vseh kovin najmanjšo gostoto in največji elektrokemični potencial in je kot tak idealen za baterijo. Preizkušati so ga pričeli že leta 1912, toda šele leta 1970 so na trg prišle prve litijeve baterije. Leta 1980 so izdelali stabilnejšo različico, tako imenovane litijeve ionske baterije, ki jo je moč ponovno napolniti. In končno so leta 1996 predstavili litijeve ionske baterije, pri katerih je elektrolit v suhem stanju (kompozitni polimer). Razvoj teh baterij še poteka in so osnova za večino mobilnih naprav.
Marjan Kodelja
