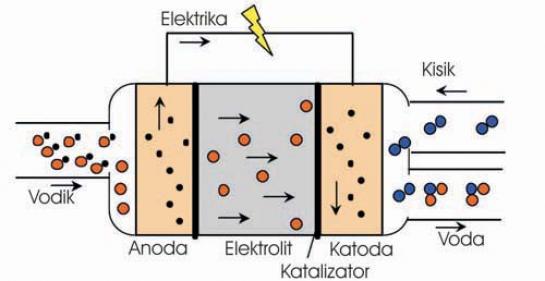
Kemično–električna reakcija znotraj celice je obrnjena elektroliza vode (izgorevanja). Pri običajni elektrolizi s pomočjo električne energije na elektrodah pridobivamo kisik in vodik. Kot vam je znano iz osnovnošolske kemije, je vsaka kemijska reakcija obrnljiva. Tako tudi ta. Iz kisika in vodika lahko pridobimo vodo. Mogoča sta dva načina, hiter in počasen: hitri tako, da vsa zadeva eksplodira, počasni pa s katalizatorji. Seveda je zanimivejša slednja, s katero pridobimo proste elektrone – električni tok. Z drugimi besedami to pomeni, da je konstrukcijsko gorivna celica zelo podobna baterijam: dve elektrodi in med njima prevodna snov − elektrolit. A vseeno z veliko razliko. Baterije za pridobivanje elektrike porabljajo kovino (nikelj, cink, svinec ...), ki je v njih, gorivne celice pa vsaj potencialno veliko cenejša vodik in kisik.
Vsaka gorivna celica, ki jo poznamo danes, deluje na osnovni ravni po opisanem teoretičnem postopku. Na obeh elektrodah je katalizator, ki nadzoruje potek kemične reakcije. Na anodo dovajajo vodik (gorivo), kjer se ta razcepi na vodikove ione (protoni) in proste elektrone. Pri eni molekuli vodika (H2) dobimo dva prosta elektrona. Elektroni »tečejo« prek električnega kroga na katodo (elektrika), na kateri se vodikovi ioni, elektroni in kisik (oksidant) združijo v vodo, pri čemer se sprošča tudi toplota. Hitro, učinkovito in predvsem čisto. Katere kemične reakcije dejansko potekajo znotraj celice, koliko prostih elektronov se sprošča in kaj prehaja prek elektrolita, pa je odvisno od tipa celice (glej okvir). Te pa imajo svoje prednosti in slabosti – ene same univerzalne celice pač ni.
KAKO CELICA PROIZVAJA ELEKTRIKO
V teoretičnem primeru bi imeli dva skladiščna prostora, enega za čisti vodik in drugega za čisti kisik. Hranjenje vodika je problematično zaradi tehničnih zahtev in strahu uporabnika, da vsa zadeva ne bi nepričakovano eksplodirala. V praksi se zato uporabljajo z vodikom bogata goriva, ki so primernejša za hranjenje. Vodik, ki je osnova za obrnjeno elektrolizo vode, je torej treba iz njih izločiti, preden ga dovajamo v celico. Pri večini celic, ki delujejo z nižjimi temperaturami (izjema je le celica DMFC) to nalogo izvaja dodatna naprava, imenovana gorivni procesor (fuel processor). Pri celicah z višjimi temperaturami pa ta proces poteka kar znotraj njih samih brez potreb po tej dodatni napravi.
Izjema v tem pravilu so celice DMFC, ki kot gorivo neposredno v celico dovajajo metanol in delujejo pri nižjih temperaturah. Ker bodo te celice največkrat uporabljene kot napajalnik za mobilne naprave, potrebujejo nekaj dodatne razlage, čeprav gre tudi v tem primeru posredno za oksidacijo vodika.
Kemična reakcija na anodi: CH3OH + H2O=>CO2 + 6H + 6e-
Kemična reakcija na katodi: 3/2O2 + 3/2H+ + 6 e- => 3H2O
Pri razpadu ene molekule metanola dobimo 6 prostih elektronov namesto dveh, ki jih sprošča razpad ene molekule vodika. Hkrati je metanol veliko gostejši, kar pomeni, da pri določeni temperaturi zasede manj prostora kot vodik. Načeloma bi lahko dejali, da ima metanol višjo energetsko gostoto hranjenja.
CELICE NISO TOPLOTNI STROJI
Najočitnejša prednost gorivnih celic, če na prvo mesto ne postavimo veliko večje prijaznosti do okolja, pred drugimi izvori električne energije je njihov velik izkoristek. Fizikalno je izkoristek razmerje med delom, ki ga stroj opravi, in energijo, ki jo vanj vložimo. Motorji z notranjim izgorevanjem so glede tega zelo potratna zadeva, saj pri njih izkoristek v večini primerov ne preseže 30 odstotkov. Dve tretjini energije goriva se kot toplota zgubi v okolico. Vsi klasični izvori električne energije (termoelektrarne in če hočete tudi jedrske) energijo goriva najprej pretvorijo v toploto in nato to v mehansko energijo (parna turbina), ki poganja generator. Fizika je dokaj jasna, za kaj je tako. Vsi toplotni stroji (torej vse, kar za pridobivanje mehanske energije uporablja obvoz prek toplotne energije) so omejeni z entropijskim zakonom, ki pravi, da je izkoristek podvržen formuli 1-T1/T2 (razmerje med temperaturo okoliškega zraka in temperaturo gorivnih plinov).
Tudi pri delovanju gorivnih celic se sprošča toplota, a celice kljub vsemu niso toplotni stroji, saj električno energijo pridobivajo neposredno. Izkoristek gorivnih celic je odvisen od tipa celice, a tudi pri najslabših ne pade pod 30 odstotkov. Zgornja meja brez dodatne uporabe sproščene toplote pa se giblje okoli 60 odstotkov. Če za pridobivanje električne energije uporabimo tudi sproščeno toploto (pridobivanje pare in pogon parnih turbin), pa se ta dvigne celo do 85 odstotkov.
Velika prednost gorivnih celic, v času globalnega segrevanja ozračja celo poglavitna, pa je dejstvo, da te veliko manj obremenjujejo okolje kot drugi stroji. V idealnem primeru uporabe zgolj vodika in kisika nastane le neškodljiva voda, ki jo mimogrede lahko uporabimo za zalivanje vrta. Tudi pri tistih celicah, ki sproščajo škodljive pline, je njihova količina bistveno manjša kot na primer pri motorjih z notranjim izgorevanjem.
VRSTE GORIVNIH CELIC
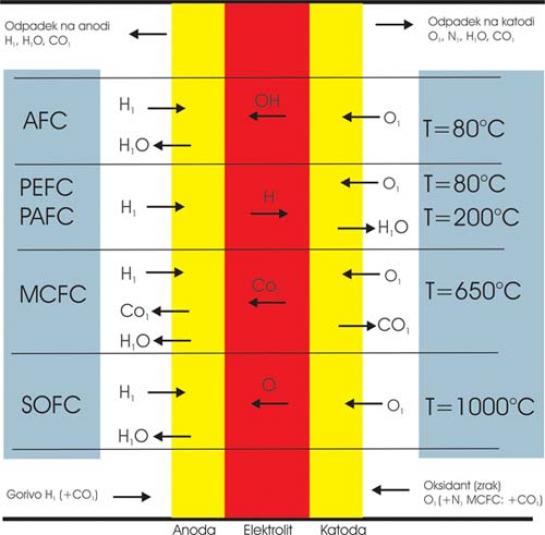
Gorivne celice se med seboj razlikujejo po uporabljenem elektrolitu. Ta določa, kateri katalizator potrebujemo, kar seveda vpliva na ceno celice, temperaturni razpon (temperatura, pri kateri je elektrolit primerno prevoden) in katero gorivo uporablja (vodik ali druga z vodikom bogata snov). V razvojnih laboratorijih razvijajo več tipov celic, v nadaljevanju pa si bomo ogledali zgolj tiste, ki največ obetajo.
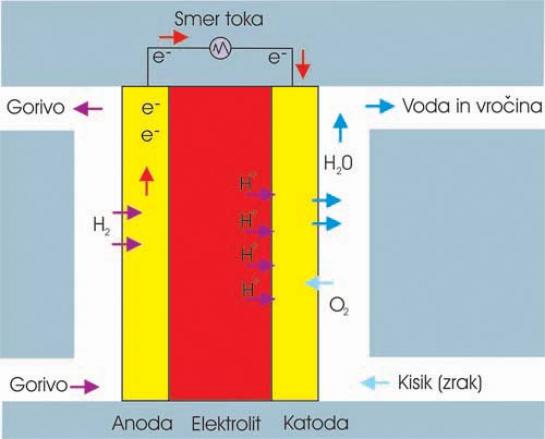
PEM (Polymer Electrolyte Membrane)
Ta tip celice omogoča razmeroma visoko energetsko gostoto, hkrati pa je lahko majhna in lahka. V njenem primeru naloge elektrolita prevzame membrana iz trdega polimera (plastika), ki prepušča protone (jedro vodika). Elektrode so iz poroznega ogljika, prevlečene s plastjo platine. Kot gorivo celica uporablja čisti vodik, ki ga dobi neposredno iz skladiščne posode ali ji ga dobavlja dodatna naprava, ki vodik pridobiva iz energetsko bogatejšega in za skladiščenje manj problematičnega goriva. Kisik pa celica dobi neposredno iz zraka.
ZA: Prednost te celice je v nizki temperaturi delovanja (80 stopinj C), kar pomeni krajši čas prehoda iz stanja nedelovanja v stanje delovanja, torej čas, ki je potreben, da se celica ogreje na delovno temperaturo. Ker je temperatura nizka, ni negativnega vpliva na druge elemente celice, kar se običajno kaže v daljši življenjski dobi teh celic.
PROTI: Celica zahteva katalizatorje iz dragih plemenitih kovin (največkrat platina), ki atomom vodika odvzemajo elektrone. Platina je draga, kar vpliva na ceno celice in je hkrati občutljiva na ogljikov monoksid (CO). Če ima celica napravo za pridobivanje vodika iz druge snovi (na primer alkohol), mora biti ta proces izredno čist, da ogljikov monoksid ne razjeda plasti platine na elektrodah. Tudi slednje vpliva na ceno celice, zato zadnje časa preizkušajo druge, manj občutljive drage kovine (zmes platine in rutenija).
PAFC (Phospheric Acid)
Ta celica je podobna prej opisani, le da za elektrolit uporablja tekočo fosforno kislino, ki je v »sendviču« (membrane) iz silicijevega karbida. Tudi tu je katalizator iz dragih kovin, kemična reakcija pa oksidacija vodika (obrnjena elektroliza vode).
ZA: Celica je veliko manj občutljiva na nečistoče v procesu pridobivanja vodika iz drugih snovi.
PROTI: Njene poglavitne slabosti so v nižjem neposrednem izkoristku, kav v praksi pomeni, da pri enaki velikosti in teži proizvajajo manj električne energije. Že pri opisu celice PEM smo omenili visoko ceno takšnih celic. Konkreten primer: cena celice PAFC se giblje med 4000 in 4500 dolarji za kilovat.
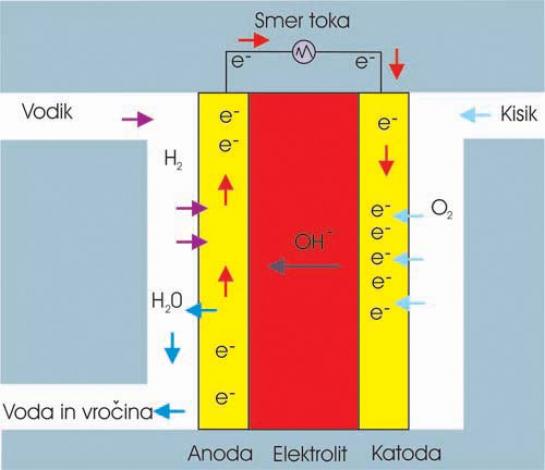
Alkalne celice (AFC)
Alkalne celice uporabljajo v ameriškem vesoljskem programu, kjer proizvajajo električno energijo in vodo. Elektrolit je zmes kalijevega hidro oksida in vode, kot katalizator pa je moč uporabiti različne, tudi dokaj cenene kovine. Temperaturno območje delovanja celic v vesoljskih plovilih je med 100 in 250 stopinj C, novejše pa dobro delujejo tudi v območju med 23 in 70 stopinj C.
ZA: Gre za visoko zmogljive celice, zaradi hitrosti kemične reakcije, ki poteka znotraj nje. Dokaj visok je tudi njihov izkoristek, ki je blizu 60 odstotkov.
PROTI: Njihova slabost je občutljivost na ogljikov dioksid (CO2). Že najmanjša koncentracija tega plina v celici vpliva na njeno delovanje (izkoristek). To pomeni, da morata biti tako vodik kot tudi kisik, ki ju dovajamo v celico, izredno čista. Postopek čiščenja pa ni ravno poceni, kar vpliva na ceno celice.
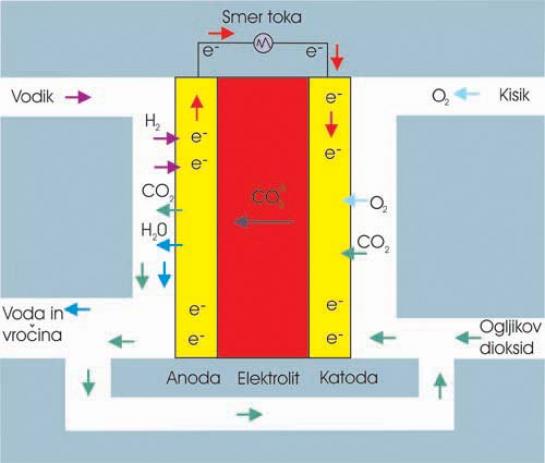
MCFC (Molten Carbonate)
Teh celi prav gotovo ne boste srečali v avtomobilih, bodo pa svoje mesto našle pri proizvodnji električne energije, v industrijski uporabi in seveda v vojaške namene. Bistvena razlika z do zdaj opisanimi celicami je v tem, da ne potrebujejo dodatne zunanje naprave za izločanje vodika iz drugih, energetsko bogatejših in za skladiščenje primernejših snovi. Ta proces zaradi visoke temperature delovanja (600–1000 stopinj C) poteka neposredno in samodejno v celici. Elektrolit je iz staljene karbonatne soli v sendviču (membrane) s poroznim litij-aluminijevem oksidom.
ZA: Ker je temperatura delovanja visoka, ni potrebe po katalizatorju iz dragih plemenitih kovin. Visok je tudi neposredni izkoristek, ki je blizu 60 odstotkov. Ta celo naraste na 85 odstotkov, če odvečno toploto uporabijo za dodatno pridobivanje električne energije. Te celice tudi niso občutljive na ogljikov monoksid ali dioksid, še več, ta plina lahko uporabljajo kot gorivo.
PROTI: Največja slabost celice MCFC je njena majhna vzdržljivost (življenjska doba), kar je neposredno povezano z visokimi temperaturami delovanja in korozivnim elektrolitom, ki ga uporabljajo.
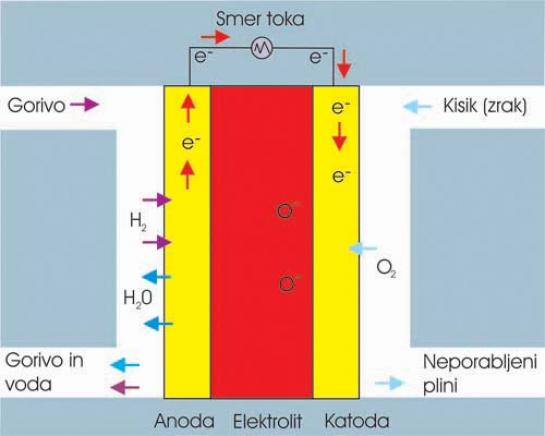
SOFC (Solid Oxide)
Celica SOFC ima elektrolit v trdi neporozni obliki, podobni keramiki (oksid), kar je velika prednost pri izdelavi in obliki celice. Prav tako deluje pri visokih temperaturah, omogoča samodejno izločanje vodika v celici, ne zahteva dragih katalizatorjev in ima neposredni izkoristek med 50 in 60 odstotkov.
ZA: Gre za eno redkih celic, ki je manj občutljiva na žveplene primesi – poleg tega, da je neobčutljiva na ogljikov monoksid in dioksid.
PROTI: Tudi pri tej celici je njena največja slabost visoka temperatura delovanja, ki vpliva na krajšo življenjsko dobo in daljši čas prehoda in nedelujočega v delujoče stanje.
DMFC (Direct Methanol Fuel Cell)
Do zdaj opisane gorivne celice niso ravno primerne za napajanje mobilnih naprav – zaradi njihove velikosti, visoke temperature delovanja in težav s skladiščenjem in prenosom goriva (predvsem vodika). Veliko primernejše so celice, ki kot gorivo neposredno in brez dodatnih naprav za izločanje vodika uporabljajo metanol (DMFC), hkrati pa njihove temperature delovanja niso previsoke. Te celice so konstrukcijsko zelo podobne celicam PEM, ki kot elektrolit uporabljajo prepustno membrano, prek katere potujejo protoni, a kot gorivo ne uporabljajo vodika, temveč metanol.
ZA: Temperaturno območje delovanja celice je med 50 in 120 stopinjami C, njihov izkoristek pa je okoli 40 odstotkov. Kot smo omenili, so zaradi svoje velikosti kljub razmeroma nizkemu izkoristku primerne za napajanje mobilnih naprav, kot so na primer mobilni telefoni.
PROTI: Nizka temperatura delovanja je tudi poglavitna slabost. Pretvorba metanola v vodikove ione (protone) in ogljikov dioksid pri nizkih temperaturah zahtevata aktivne katalizatorje. Z drugimi besedami, to pomeni večje količine plemenitih kovin (platine) na elektrodah – kar seveda pomeni višjo ceno celice. Problem je tudi v metanolu samem, ki je strupen in zato morebiti ni tako primeren za množično rabo.
Marjan Kodelja
